占中国药品批文95%以上!仿制药的质量到底行不行? 
CC情报局

2024年09月11日 17:22:10 来自北京市
872人参与70评论


核心提要: 1. 中国国家医保局近期宣布,暂停进口印度瑞迪博士实验室进入中国集采的仿制药物盐酸托莫西汀胶囊。这家涉事的仿制药企业在印度排名第3,全球排名前10。这一仿制药爆雷事件,引发人们对中标仿制药的有效性和安全性的担忧。 2. 据国家卫健委数据,在目前4000多家中国制药企业中,90%以上是仿制药企业。全国17万药品批文中,95%以上也是仿制药。中国这些年来一直致力于进行仿制药质量和疗效的评价,不断细化评价方法、参比制剂、临床试验等方面内容,采取一致性评价措施,以提高仿制药质量。 3. 在制药界,一个无法避免的话题是集采,即药品的集中带量采购。带量集采希望达到三个目的:药价低、药效高、药物的供应量充足。但是,当经济周期进入下行轨道,大家都面临降本增效的时候,如果价格是最关键的指标,就不可避免会有“偷工减料”发生,节约成本带来的是药物治疗效果的降低,以及药物的质量问题。只有真正被老百姓认可、有效,仿制药才会成为好药。要达到这几个目标,仿制药还有很长的路要走。 作者丨张洪涛 凤凰网《CC情报局》特约撰稿员 编辑丨白金娜、黄舒琪、王俊豪 
印度仿制药再爆雷? 研究表明,一款进入中国的印度仿制药“未达到应有的血药浓度” 8月30日,中国国家医保局宣布印度瑞迪博士实验室进入集采的仿制药物盐酸托莫西汀胶囊,在原料药、工艺验证、质量控制等方面存在缺陷,对该产品采取暂停进口、销售和使用措施! 盐 酸托莫西汀是第一个被FDA批准用于治疗多动症的药物, 由于中国药品集采的价格竞争,礼来的原研产品已于今年1月在中国停止供应。 也就是说, 这款原研进口药已无法在医院买到。 
这家出事的印度 瑞迪博士实验室是印度排名第三的仿制药企业, 全球排名前十。这一仿制药爆雷事件,引发人们对中标仿制药的有效性和安全性的担忧。 就在处罚令下达不久,这家印度公司旗下的另一款精神病仿制药奥氮平 再爆出现了“未达到血药浓度”的问题。 
奥氮平是第一个获准用于治疗急性双相躁狂症的非典型抗精神病药物,原研厂家为礼来 。奥氮平的中国首仿是江苏豪森,于2001 年上市,是全国首家通过一致性评价, 市场占有率60%以上的氮安平仿制药。2019年,号称“价格屠夫”的印度迪瑞旗下的仿制药奥氮平片(奥兰之),以超低价格6.19元/片价格中标。 而上一轮“4+7”中,豪森药业的中标价为9.64元/片。 
印度版氮安平中标,意味着中国相关医院,要从之前的仿制药再转换到新的中标仿制药,这两种仿制药之间的治疗效果是否一致,这些药物是否与原研品牌药一样安全有效? 由湘雅二院国家精神障碍临床研究中心、宁波康宁医院进行的一项研究表明,在30名患者中,从集采前的氮安平仿制药转换到中标的印度仿制药之后,结果显示印度迪瑞的这款中标仿制药奥氮平的“血药浓度显著低于另一款中国仿制药。” 同时表明,两种仿制药之间“可能不具有治疗等效性或生物等效性。每次转换都可能造成疗效或耐受性的变化。” 
这篇研究发表于《药理学前沿》。这项研究虽然表明,“在换药前后没有显著差异。” 但血药浓度不够,对于一款药物的治疗效果,可能是一个严重的潜在问题! 实 际上, 能否达到药物的有效浓度,是一款药物能否达到理想药效的关键! 药物血浆浓度与药品的临床应用密切相关。许多疾病往往都会对所服用的药物有明确数值的血药浓度标准。只有血药浓度达到有效浓度才能显效,浓度越高效果越强,但如超出了安全范围则可显示出毒性反应。 
这篇论文的研究者建议, 患者在两个仿制药之间转换时,可能需要对疗效或耐受性的变化进行检测。 研究者还同时建议药企应披露所有上市仿制药和品牌药的药理等效性和生物等效性数据,并制定后续临床样本治疗等效性评估和治疗不等效性监测程序的指导原则。 

为何要对2007年10月之前的仿制药进行一致性评价? 仿制药之间都有差异,那么仿制药和原研药之间是否有更大的差异呢? 在一篇最近引发广泛争议的自媒体文章的文章中(“很多进口药,悄无声息的消失了”),讲述了一个杭州家长得了支原体感染,开不到进口药,只有国产注射型阿奇霉素,治疗效果不好,后终于用上了进口药物,孩子的高烧当天就退了下来。 虽然这可能仅是个案,但不仅是普通的消费者对仿制药的质量忧心忡忡,医务人员同样有这样的担心。 《健康政策》上发表过一篇关于“医生对仿制药的看法”的调查报告,调查时间为2020 年,调查范围是全国各地的医师,共有598人参与调查。其中,仅有 35.8%的人认为仿制药与原研药有同等治疗效果, 36.5%的人认为仿制药和原研药的安全性一致。只有一半的人(49.2%)愿意给自己的病人或家人使用仿制药,而 45%的人更愿意推荐使用原研进口药,即便其价格更高。[2] 据卫健委的数据,目前4000多家中国制药企业中,90%以上都是仿制药企业。全国17万药品批文中,95%以上都是仿制药。 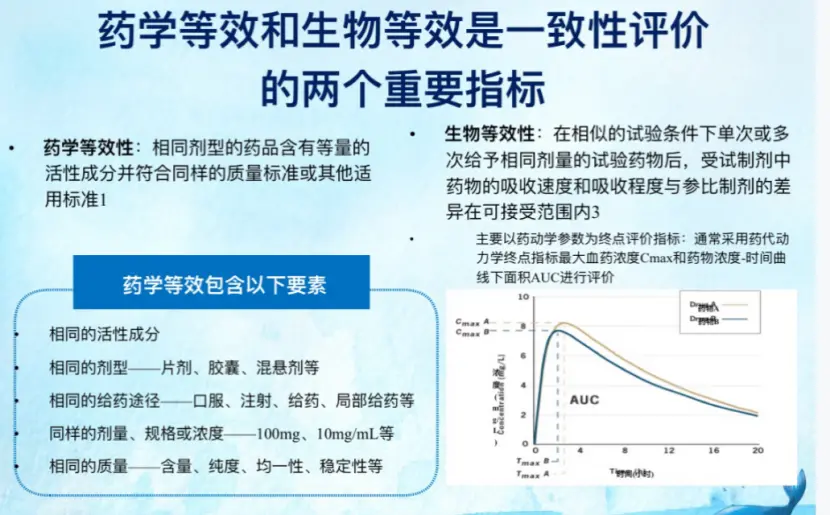
仿制药的质量行不行?要回答这个问题,需要的不是口号,而是规范化的审批流程及监管。 因为历史性的原因,也因为中国的现代制药技术之前不够先进,仿制药的水平是参差不齐的,甚至有经常包含假冒伪劣药品。针对这个问题,中国开始全面推广实施“仿制药一致性评价”,在2002年,《药品管理法实施条例》生效,仿制药的审核标准得到统一。2007年,药监局规定仿制药应在五个方面与原研品牌药保持一致:(1)活性成分;(2)给药途径;(3)剂型;(4)规格;(5)治疗效果。 2012年至2018年,先后三次颁发文件,要求对2007年10月1日前批准上市的化学药品仿制药口服固体制剂完成一致性评价,期限为2018年年底前。所涉及的仿制药品品种为289个。 可见,中国这些年来一直致力于进行仿制药质量和疗效的评价,不断细化评价方法、参比制剂、临床试验等方面内容,以提高仿制药的治疗。目前中国通过一致性评价(包括视同通过)的受理号已超过7000个,涉及药品超过1000个。 但是,一致性评价要与原研药做对比,由于原研药的价格有差异,不同药物的一致性评价成本也就不可能相同。但是可以看出,做一个一次性评价,至少需要数百万元的投入。 一致性评价这个措施,增加了药物的成本,但提高了仿制药的质量。 
▎仿制药一致性评价标志 
数十家知名跨国药企与中国仿制药企,因药品质量等问题,被停止集采中选资格 在制药界,一个无法避免的话题,是药品的集中带量采购,简称集采。 当然,集采并不是中国的特色,在2024年,美国也开始了集采。所不同的是,美国集采的品种,主要是已经上市多年的药物,而在中国,集采的不仅仅是仿制药,还包括了刚上市不久的创新药。 
集采的一个目的,是把药价打下来。 在中国,这个效果是非常明显的,多家药品生产企业参与集采竞标,其实也是在打价格战。进入集采的药物,价格都会腰斩,甚至膝斩。 数据表明,进入“4+7”集采之后,中标的原研药和仿制药日均费用分别减少了44.44%和79.00%,没有进入集采的原研药也感受到了压力,日均费用减少了15.10%。【3】 但是打压药价,并非是唯一的目的。事实上,至少在中国,带量集采希望达到三个目的:药价低、药效高、药物的供应量充足。 
为了保证药效高,集采要求中选药品必须通过一致性评价,确保与原研药在质量和疗效上一致。同时,有关部门还会加强全流程质量监管和抽检频次,对违法违规企业进行追责。 在中标品种的价格基础上,会制定出医保支付标准,从而引导医疗机构和患者形成合理的用药习惯,从需求端来刺激药品的生产,鼓励药企提供充足的药物。 对于一些家底比较殷实的制药企业,集采有助于他们本就想展开的价格战,挤掉一些体量比较小的竞争者。但是,当经济周期进入下行轨道,大家都面临降本增效的时候, 如果价格是最关键的指标,就不可避免会有“偷工减料”发生。 生产奥氮平片的印度瑞迪博士实验室,其以“价格屠夫”著称, 以超低的价格打败之前进入集采的国产仿制药与原研药,但其价低同时并没有保证药物质量, 今年8月底,国家医保局暂停了瑞迪博士实验室参与国家集采的资质,而此前印度排名第一的太阳制药也因仿药质量问题,被中国取消集采中选资格。印度是全球最大的仿制药生产国, 但数据造假、管理粗放、成本压缩等问题长期未能解决。 
而据统计,包括韩国大熊制药的注射用头孢地嗪钠、葛兰素史克公司(GSK)度他雄胺胶囊、优时比公司的抗癫痫药左乙拉西坦注射用浓溶液等,先后因药物微生物污染、质量问题等,被取消集采中选资格。 仿制药并非中国特色。有数据显示,2015 年美国市场上 89%的药物是仿制药,其中大部分来自印度。据《仿制药的真相》一书披露:“为降低成本,在经理的授意下,公司的科学家们将高纯度成分替换成低纯度成分,以节约成本。” 节约成本带来的是药物治疗效果的降低,以及药物的质量问题。 因为无法承受价格的压力,一些进口原研药放弃竞标,甚至退出了中国市场。与此同时,在进口药悄无声息地消失的时候,一些中标的集采药也消失了。 据媒体不完全统计,只有161种进口药未在中国再注册,其中不乏过去临床常用的知名药品。 这可能就是我们很难在医院买到进口原研药的原因之一了吧! 但对老百姓来说,评价药物好坏,不看广告,看疗效! 只有仿制药真正被老百姓认可,有效,仿制药才会成为好药! 但这一天,估计仍有漫长的路要走。
|